


河南省傳染病醫(yī)院 鄭州市第六人民醫(yī)院
2024年度藥物(器械)臨床試驗倫理審查申請/報告指南(2023年12月27日頒布)
指導(dǎo)主要研究者/申辦者提交藥物/醫(yī)療器械/體外診斷試劑臨床試驗項目在我院藥物(器械)臨床試驗倫理委員會遞交倫理審查申請/報告,特制訂本指南。
一、提交倫理審查的研究項目范圍
根據(jù)國家藥品監(jiān)督管理局“藥物臨床試驗倫理審查工作指導(dǎo)原則”(2010年)、“疫苗臨床試驗技術(shù)指導(dǎo)原則”(2013年)、“藥物臨床試驗質(zhì)量管理規(guī)范”(2020年)、 “醫(yī)療器械臨床試驗質(zhì)量管理規(guī)范”(2022年),國家衛(wèi)生健康委“涉及人的生物醫(yī)學(xué)研究倫理審查辦法”(2016年)、“涉及人的生命科學(xué)和醫(yī)學(xué)研究倫理審查辦法”(2023年)、“涉及人的臨床研究倫理審查委員會建設(shè)指南”(2020年),國家中醫(yī)藥管理局“中醫(yī)藥臨床研究倫理審查管理規(guī)范”(2010年),下列范圍的研究項目應(yīng)依據(jù)本指南提交倫理審查申請報告:
1、藥物臨床試驗;
2、醫(yī)療器械、體外診斷試劑臨床試驗;
二、倫理審查申請/報告的類別
初始審查
初始審查申請:“初始審查申請”是指項目實(shí)施前首次向倫理委員會提交的審查申請。符合倫理審查范圍的研究項目,應(yīng)在研究開始前提交倫理審查申請,經(jīng)倫理委員會批準(zhǔn)后方可實(shí)施。
跟蹤審查
修正案申請:研究過程中若對研究方案、知情同意書、招募廣告、研究者手冊以及給到受試者的材料(如受試者日記卡及調(diào)查問卷等)的修改,均應(yīng)以“修正案申請”的方式及時提交倫理委員會審查,批準(zhǔn)后方可實(shí)施。
年度/定期跟蹤審查申請報告:申請人應(yīng)按照倫理審查意見規(guī)定的年度/定期跟蹤審查頻率,在截止日期前1個月提交研究進(jìn)展報告;申辦者應(yīng)當(dāng)向組長單位倫理委員會提交各中心研究進(jìn)展的匯總報告;當(dāng)出現(xiàn)任何可能顯著影響試驗進(jìn)行、或增加受試者危險的情況時,應(yīng)以“研究進(jìn)展報告”的方式,及時報告?zhèn)惱砦瘑T會。如果未按跟蹤審查頻率(逾期一個月)遞交研究進(jìn)展報告的,倫理委員會可以終止其試驗的繼續(xù)進(jìn)行。
安全性信息報告:本中心發(fā)生嚴(yán)重不良事件時研究者應(yīng)當(dāng)立即(獲知后的24 h內(nèi))向倫理委員會書面報告所有嚴(yán)重不良事件,隨后應(yīng)當(dāng)及時提供詳盡、書面的隨訪報告和總結(jié)報告。具體要求見藥物(器械)臨床試驗安全性事件上報倫理要求(附件13)。
研究者手冊:試驗實(shí)施期間,如有更新,研究者需要向倫理委員會提交更新后的研究者手冊。如因研究者手冊更新而修訂方案和/或知情等的,應(yīng)與相關(guān)材料一起,按修正案申請?zhí)峤唬徊恍抻喎桨负?或知情的,在年度/定期跟蹤審查中以研究進(jìn)展報告的形式遞交。
藥物研發(fā)期間安全性更新報告(DSUR),如因DSUR更新而修訂方案和/或知情等的,應(yīng)與相關(guān)材料一起,按修正案申請?zhí)峤唬恍抻喎桨负?或知情的,在年度/定期跟蹤審查中以研究進(jìn)展報告的形式遞交。
方案偏離:臨床試驗實(shí)施中為消除對受試者緊急危害的試驗方案的偏離,事后應(yīng)及時向倫理委員會報告。其他方案偏離每三個月匯總以方案偏離匯總表報告?zhèn)惱砦瘑T會。
方案違背:重大違背方案(包括:1.納入不符合納入標(biāo)準(zhǔn)或符合排除標(biāo)準(zhǔn)的受試者;2.研究過程中,符合終止試驗的規(guī)定而沒有讓受試者退出;3.給予受試者錯誤的治療或不正確的劑量(超過20%以上的);4.給予受試者方案禁用的合并用藥;5.可能對受試者的權(quán)益、安全造成顯著影響的情況,可能對研究的科學(xué)性產(chǎn)生顯著影響的情況)和持續(xù)違背方案(同一研究者的同一違規(guī)行為在被要求糾正后,再次發(fā)生)應(yīng)及時向倫理委員會報告。
暫停/提前終止研究報告:研究者/申辦方暫停或提前終止臨床研究,應(yīng)及時向倫理委員會提交暫停/提前終止研究報告。
結(jié)題報告:完成臨床研究,應(yīng)及時向倫理委員會提交結(jié)題報告。
復(fù)審
復(fù)審申請:初始審查和上述跟蹤審查后,倫理審查意見為“作必要修正后同意”,對項目資料按照審查意見進(jìn)行修改后,應(yīng)以“復(fù)審申請”的方式再次送審,經(jīng)倫理委員會批準(zhǔn)后方可實(shí)施;如果對倫理審查意見有不同的意見,可以在“復(fù)審申請”時申訴,請倫理委員會考慮。 以上審查所需要遞交的材料清單參考送審文件目錄清單(附件1)
三、提交倫理審查的流程
對資料的要求:
1、請按照送審文件目錄清單(附件1)準(zhǔn)備原件1套,只需要中文版資料,自備文件盒,具體要求參考《文件盒模板》(附件10)。所交文件資料需蓋封面章和騎縫章(限申辦方制訂的文件如:方案、知情等;不是申辦方制訂的文件,如NMPA批件、藥檢報告、保險等,不需要蓋章)
2、初始審查會審需準(zhǔn)備復(fù)印件15套,只需要中文版資料,除研究團(tuán)隊資質(zhì)證明文件和經(jīng)濟(jì)利益聲明可省略其他資料內(nèi)容與原件相同,可簡裝。其他跟蹤審查會審前會有具體要求。
3、修正案審查遞交原件1套,自備文件盒,具體要求參考《文件盒模板》(附件10),如需會審,則準(zhǔn)備復(fù)印件15套,包括:修正對比表、組長單位倫理審查意見及其他修改文件。修正后的方案和/或知情同意新版本不需要復(fù)印。
提交送審文件:遞交資料給倫理委員會,根據(jù)倫理審查申請/報告的類別,符合但不限于下列情況時需填寫相應(yīng)的“申請表或報告”:
1) 初始審查時,請根據(jù)研究項目的類型,按照對應(yīng)的《送審文件目錄清單》(附件1)準(zhǔn)備送審文件,填寫相應(yīng)類型的《倫理審查申請表》(附件2-3)、《研究材料誠信承諾書》(附件24-25);
2) 倫理審查意見為“作必要修正后同意”,再次提交資料時填寫《復(fù)審申請表》(附件22),修改之處以《修正對比表》(附件12)列明;
3) 研究過程中對研究方案、知情同意書、招募廣告、研究者手冊以及給到受試者的材料(如受試者日記卡及調(diào)查問卷等)進(jìn)行修改,按照對應(yīng)的《送審文件目錄清單》(附件1)準(zhǔn)備送審文件,填寫《修正案申請表》(附件11),修改之處以《修正對比表》(附件12)列明;
4) 安全性信息報告參考《藥物(器械)臨床試驗安全性事件上報倫理要求》(附件13),填寫《嚴(yán)重不良事件報告》(附件14-15),申辦方對嚴(yán)重不良事件是否為SUSAR進(jìn)行判斷,填寫《嚴(yán)重不良事件評估表》(附件16),外院或其他來源安全性事件每三個月遞交安全性信息匯總表(附件17);
5)研發(fā)期間如發(fā)生妊娠事件,填寫《妊娠事件報告表》(附件27);
6 )研究期間發(fā)生了方案偏離事件填寫《方案偏離匯總表》(附件18);
7)研究期間發(fā)生了違背方案事件填寫《違背方案報告表》(附件19);
8) 遞交年度/定期跟蹤審查報告填寫《研究進(jìn)展報告》(附件20);
9) 研究需暫停或未按照方案完成試驗需提前終止的填寫《暫停/提前終止研究報告》(附件21)和研究總結(jié)報告(如有);
10) 項目按照方案完成試驗后填寫《研究完成報告》(附件23)和研究總結(jié)報告;
11) 如涉及到生物樣本外送至第三方檢測單位,需提供申辦方蓋公章的《人類遺傳資源外送承諾書》(附件26);
提交形式:遞交初始審查資料,需遞交紙質(zhì)版材料至倫理委員會辦公室。文件盒及裝訂要求參考文件盒簽?zāi)0澹ǜ郊?0)。
領(lǐng)取通知
補(bǔ)充/領(lǐng)取送審材料通知:倫理委員會辦公室受理后,如果認(rèn)為送審文件不完整,文件要素有缺項,會當(dāng)面/電話告知缺項文件、缺項的要素,以及最近審查會議前的送審截止日期。
受理通知:送審文件的完整性和要素通過形式審查,秘書將告知預(yù)計審查日期。
接受審查的準(zhǔn)備
會議時間/地點(diǎn):行政樓4樓大會議室(會前秘書會建群通知注意事項)。
準(zhǔn)備向會議報告:按照通知,主要研究者和項目CRA必須到會,以幻燈片等電子形式介紹項目的情況(主要介紹研究方案和知情同意書),介紹時間5分鐘左右。由主要研究者報告,CRA協(xié)助答疑。倫理審查匯報PPT要求及模板(附件7)。
四、倫理審查的時間
倫理委員會通常每月第三周的周四下午例行召開審查會議1次,需要時可以增加審查會議次數(shù)。倫理委員會辦公室受理送審文件后,一般需要提前進(jìn)行處理,請在會議審查前至少提前5天提交送審文件。逾期則安排在下一個月評審,如遇節(jié)假日或特殊情況,會議時間將另行安排并及時公布。2024年會議時間安排如下表:
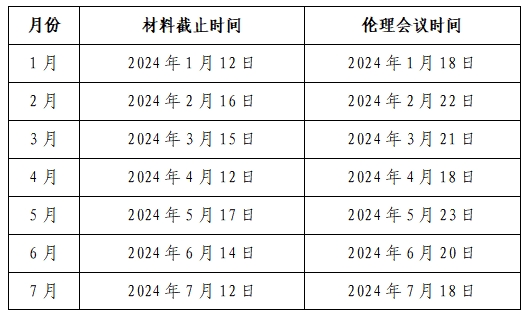
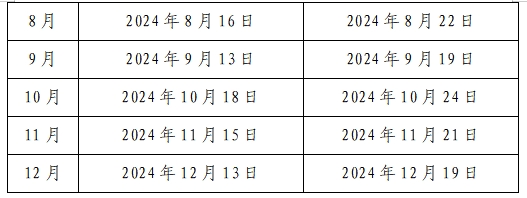
研究過程中出現(xiàn)重大或嚴(yán)重問題,危及受試者安全時,或發(fā)生其它需要倫理委員會召開會議進(jìn)行緊急審查和決定的情況,倫理委員會將召開緊急會議。
五、審查決定的傳達(dá)
倫理委員會辦公室在做出倫理審查決定后5個工作日內(nèi),以“倫理審查意見”書面?zhèn)鬟_(dá)審查決定給研究者/申辦方。
六、倫理審查的費(fèi)用
初始審查費(fèi)6000元整(含稅)(該項包含初審的復(fù)審)
修正案審查費(fèi)3000元整(含稅)
年度/定期跟蹤審查、安全性事件審查、違背方案審查、研究完成審查、暫停/終止研究審查不再收費(fèi)。
倫理審查費(fèi)應(yīng)在倫理會議前交納,倫理審查費(fèi)轉(zhuǎn)賬至醫(yī)院賬戶,可提供發(fā)票。具體見倫理發(fā)票申請單(附件9)。
銀行賬戶名稱:鄭州市第六人民醫(yī)院
開戶銀行:鄭州銀行嵩山南路支行
帳號:920450020109001965
匯款請備注“XXXX項目倫理初審/修正案審查費(fèi)”
七、研究實(shí)施前的注意事項
1、按照臨床研究相關(guān)規(guī)定,經(jīng)倫理委員會批準(zhǔn)的藥物、器械等研究項目在實(shí)施前,申辦者應(yīng)當(dāng)在https://clinicaltrials.gov/、中國臨床試驗注冊中心http://www.chictr.org.cn/、國家藥品監(jiān)督管理局藥品審評中心藥物臨床試驗登記與信息公示平臺http://www.chinadrugtrials.org.cn/等系統(tǒng)中完成注冊。
2、按照國家衛(wèi)生健康委員會《涉及人的生物醫(yī)學(xué)研究倫理審查辦法》規(guī)定,經(jīng)倫理委員會批準(zhǔn)的研究項目在實(shí)施前,研究項目負(fù)責(zé)人應(yīng)當(dāng)在醫(yī)學(xué)研究登記備案信息系統(tǒng)進(jìn)行登記。(網(wǎng)址:http://114.255.48.20)。
3、屬“人類遺傳資源行政許可事項”規(guī)定范疇的研究,應(yīng)按相關(guān)法規(guī)進(jìn)行審批,獲得中國人類遺傳資源管理部門批準(zhǔn)后方可實(shí)施,申辦者應(yīng)及時將批準(zhǔn)文件交倫理委員會備案。
4、屬《需進(jìn)行臨床試驗審批的第三類醫(yī)療器械目錄》內(nèi)醫(yī)療器械的臨床試驗,獲得倫理批準(zhǔn)后應(yīng)按相關(guān)法規(guī)進(jìn)行審批,獲得NMPA批準(zhǔn)后及時將批準(zhǔn)文件交倫理委員會備案。
八、聯(lián)系方式
倫理委員會名稱:河南省傳染病醫(yī)院(鄭州市第六人民醫(yī)院)藥物(器械)臨床試驗倫理委員會
聯(lián)系人:雒琦
聯(lián)系電話:0371-55177690
Email:zzlylunli@126.com
辦公地址:8號樓3樓藥物(器械)臨床試驗倫理辦公室
工作時間:上午8:00--12:00,下午14:30--17:30(法定節(jié)假日除外)
九、附件表格
1. 送審文件目錄清單
2. 初審申請表(藥物)
3. 初審申請表(醫(yī)療器械/體外診斷試劑)
4. 研究者簡歷模板
5. 研究經(jīng)濟(jì)利益聲明
6. 臨床試驗研究團(tuán)隊成員表
7. 倫理審查匯報PPT要求及模板
8. 收費(fèi)標(biāo)準(zhǔn)及匯款賬號
9. 倫理發(fā)票申請單
10. 文件盒簽?zāi)0?/p>
11. 修正案審查申請
12. 修正對比表
13. 藥物(器械)臨床試驗安全性事件上報要求
14. 嚴(yán)重不良事件報告(藥物)
15. 嚴(yán)重不良事件報告(器械)
16. 嚴(yán)重不良事件評估表
17. 安全性信息會中標(biāo)
18. 方案偏離匯總表(非重大違背)
19. 違背方案報告表(重大/持續(xù)違背)
20. 研究進(jìn)展報告
21. 暫停/提前終止研究報告
22. 復(fù)審申請表
23. 研究完成報告
24. 研究材料誠信承諾書(申辦方)
25. 研究材料誠信承諾書(主要研究者)
26. 人類遺傳資源外送承諾書
27. 妊娠事件報告表
醫(yī)院地址:二七區(qū)京廣南路29號(京廣路與長江路交叉口)
乘62、81、126、203、553、556、563、906、981、B16、Y17、111、B1路直達(dá) 地鐵:五號線京廣南路站·市第六人民醫(yī)院下車向南500米
聯(lián)系電話 0371-60331627 鄭州市第六人民醫(yī)院 www.zssiyanli.com ? Copyright 2020 版權(quán)所有 豫ICP備15005665號-1
技術(shù)支持:河南維康軟件有限公司
