


一、嚴重不良事件(SAE)的報告
1.SAE報告要求:
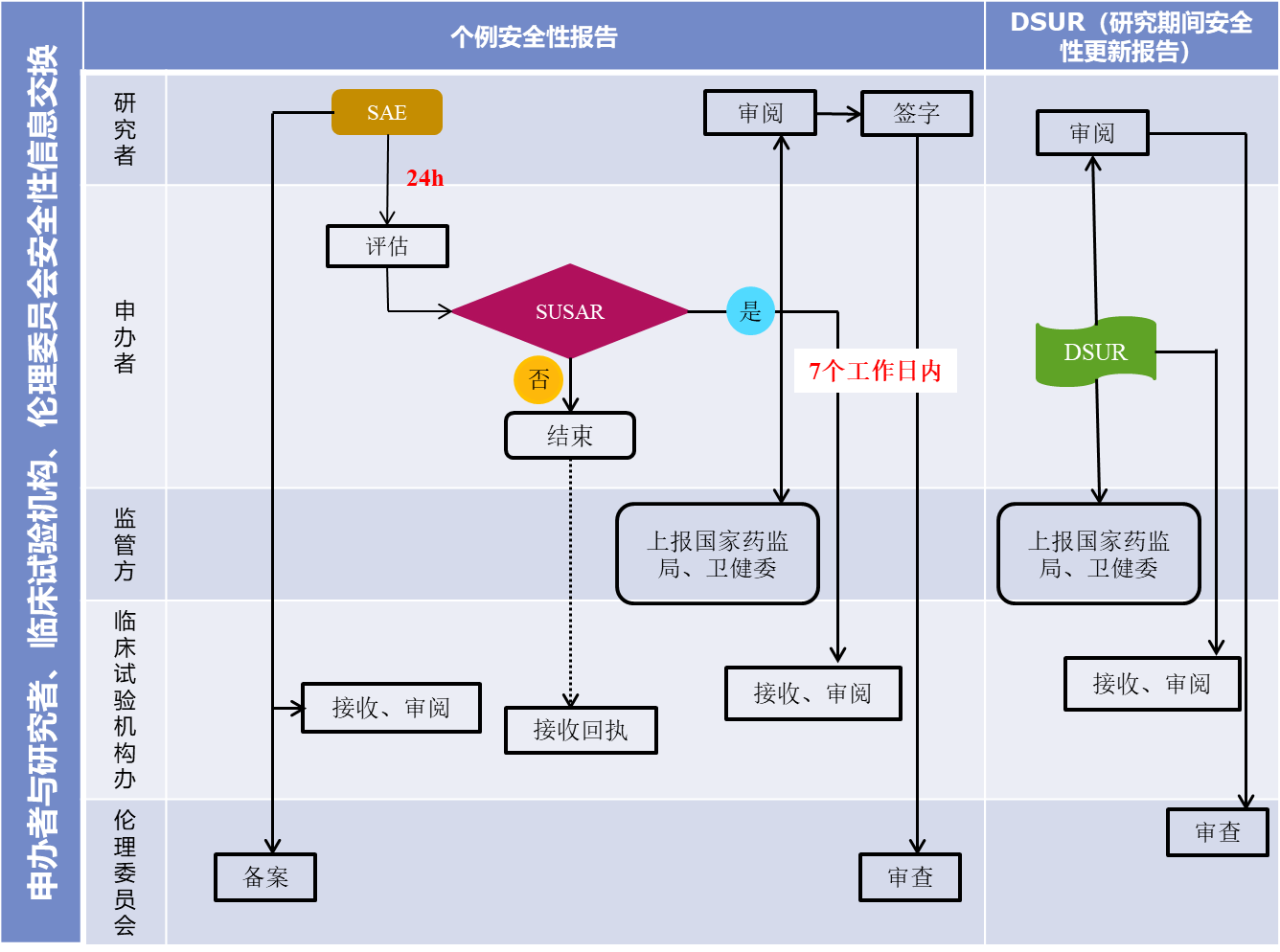
除試驗方案或者其他文件(如研究者手冊)中規定不需立即報告的嚴重不良事件外,研究者需在獲知SAE發生的24小時內報告給申辦方(除非在研究方案中另有約定),同時將掃描件上傳至機構安全性數據接收郵箱(zzlylcsysae@163.com,郵件命名:PI-項目名稱-受試者隨機號-SAE名稱-首次/隨訪/總結報告)。紙質版報告應在電子版上傳后1-2個工作日內遞交至機構安全管理員。研究者需對本項目中所有SAE進行編號以便于管理。(SAE編號:方案編號-受試者編號-xx(第幾次)-a/b/c(a:首次;b:隨訪;c:總結))。機構安全管理員負責接收、審核SAE報告,填寫《SAE報告回執表》(附件2)。
研究者還應當及時提供詳盡、書面的隨訪報告。 涉及死亡事件的報告,研究者應當向申辦者、臨床試驗機構和倫理委員會提供其他所需要的資料,如尸檢報告和最終醫學報告。
書面報告時,應當注明受試者在臨床試驗中的鑒認代碼,而不是受試者的真實姓名、公民身份號碼和住址等身份信息;應保證報告內容完整、準確,以提供申辦者評估。SAE報告表原件應保存在研究者文件夾/受試者文件夾中。
2.SAE報告時限:
2.1首次報告:研究者需在獲知SAE發生的24小時內報告給申辦方、臨床試驗機構、倫理委員會。若研究者將SAE與試驗藥物的相關性判斷為肯定有關/很可能有關/可能有關時,需初步判斷此SAE是否為SUSAR,并在《SAE報告表》的詳細情況中進行描述。
2.2隨訪報告:研究者定期追蹤事件的發展,獲知SAE隨訪結果后的24小時內書面報告給申辦方、臨床試驗機構、倫理委員會。
2.3總結報告:SAE癥狀消失或達到穩定狀態,或者受試者失訪、死亡。研究者將總結報告書面報告給申辦方、臨床試驗機構、倫理委員會。
3.申辦者收到SAE報告后,應當立即分析評估該事件是否為可疑且非預期嚴重不良反應(SUSAR),填寫《SAE評估表》(附件3)。申辦者需7日內將《SAE評估表》經研究者審核簽字后,將掃描件上傳至機構安全性數據接收郵箱,紙質版遞交至機構安全管理員。
4.倫理委員會對SAE上報要求:具體要求詳見本院倫理委員會相關規定。
二、可疑且非預期嚴重不良反應(SUSAR)報告
申辦者收到任何來源的安全性相關信息后,應當立即分析評估,并將SUSAR快速報告給所有參加臨床試驗的研究者及臨床試驗機構、倫理委員會;申辦者應當向藥品監督管理部門和衛生健康主管部門報告SUSAR。
具體上報時限及要求如下:
1.對于致死或危及生命的非預期嚴重不良反應,申辦者應在首次獲知后盡快報告,但不得超過7天,并在隨后的8天內報告、完善隨訪信息。(申辦者首次獲知當天為第0天)。
2.對于非致死或危及生命的非預期嚴重不良反應,申辦者應在首次獲知后盡快報告,但不得超過15 天。
3.SUSAR報告遞交臨床試驗機構:
申辦者將加蓋公章的紙質版報告遞交研究者,經研究者審核簽字后,遞交臨床試驗機構安全管理員。SUSAR報告時限以《SUSAR報告遞交函》(附件3)簽收時間為準。臨床試驗機構安全管理員需及時審閱本院發生的SUSAR,外院SUSAR則可按季度集中審閱。
申辦者從其它來源獲得的與試驗藥物相關的非預期嚴重不良反應及其他潛在嚴重安全性風險的信息也應當向機構備案。無論境內、境外的個例安全性報告及其他潛在嚴重安全性風險報告均應采用中文報告。
4.SUSAR報告遞交倫理委員會:具體要求詳見本院倫理委員會相關規定。
三、安全性更新報告(DSUR)
1.申辦者應當分析評估任何來源的安全性相關信息(包括文獻、數據與安全監察報告、期中分析結果),應當將臨床試驗中發現的可能影響受試者安全、可能影響臨床試驗實施、可能改變倫理委員會同意意見的問題,及時通報所有參加臨床試驗的研究者、臨床試驗機構及倫理委員會。
2.DSUR的具體撰寫與遞交要求,需參照ICH-E2F及CDE《研發期間安全性更新報告要求及管理規定》。
3.報告時限參照ICH-E2F及CDE《研發期間安全性更新報告要求及管理規定》,進行年度報告遞交,原則上報告周期不超過一年。
4.申辦者將加蓋公章的紙質版報告(需附帶《DSUR遞交函》(附件5)遞交至臨床試驗機構安全管理員,并由其簽收審閱。
5. DSUR報告遞交倫理委員會:具體要求詳見本院倫理委員會相關規定。
四、附件
附件1:SAE報告回執表http://www.zssiyanli.com/upload_files/2020/0929/20200929105935797.docx
附件2:SAE評估表http://www.zssiyanli.com/upload_files/2020/0929/20200929105946499.docx
附件3:USAR報告遞交函http://www.zssiyanli.com/upload_files/2020/0929/20200929110107334.docx
附件4:SUR遞交函http://www.zssiyanli.com/upload_files/2020/0929/20200929110123110.docx
臨床試驗安全性事件報告的SOPhttp://www.zssiyanli.com/upload_files/2020/0929/20200929110334595.docx
臨床試驗安全性報告流程圖

醫院地址:二七區京廣南路29號(京廣路與長江路交叉口)
乘62、81、126、203、553、556、563、906、981、B16、Y17、111、B1路直達 地鐵:五號線京廣南路站·市第六人民醫院下車向南500米
聯系電話 0371-60331627 鄭州市第六人民醫院 www.zssiyanli.com ? Copyright 2020 版權所有 豫ICP備15005665號-1
技術支持:河南維康軟件有限公司
